Molekülkino aus Hamburg
Forschungsbericht (importiert) 2015 - Max-Planck-Institut für Struktur und Dynamik der Materie
Einleitung
Lebendige Materie ist dynamisch und weist Bewegungen mit charakteristischen Längen- und Zeitskalen auf. Diese Skalen hängen miteinander zusammen: Kleinere Einheiten zeigen schnellere Bewegungen. Was als „Leben“ verstanden und wahrgenommen wird, basiert im Detail auf chemischen Prozessen und Transformationen auf atomarer Ebene im Ångström-Bereich, das heißt auf Längenskalen von weniger als einem Nanometer (Milliardstel Meter). Diese Größenskalen sind jedoch kleiner als die Wellenlänge sichtbaren Lichts (einige hundert Nanometer); daher werden Alternativen zur optischen Mikroskopie benötigt, um die atomaren Bewegungen abzubilden und einen sogenannten molekularen Film (molecular movie) dieser Prozesse zu erstellen. Im Vergleich zu hochenergetischem Röntgenlicht wird Elektronen bereits ab einer Energie von etwa 150 Elektronenvolt eine kürzere Wellenlänge im sub-Ångström-Bereich zugeordnet; die Schwierigkeit liegt hier jedoch in der Überwindung der Raumladungseffekte, die Elektronenpulse wegen ihrer Dichte und der Ladung der Elektronen aufweisen. Die gegenseitige Abstoßung der Elektronen limitiert die Helligkeit (brightness), die mit einer gepulsten Elektronenquelle erzeugt werden kann, und damit die räumliche und zeitliche Auflösung, mit der sich dynamische Prozesse beobachten lassen. Daher widmet sich die Arbeitsgruppe von R.J. Dwayne Miller intensiv der Entwicklung heller Elektronenquellen, um die Grenzen der darstellbaren strukturellen Komplexität und des Detailreichtums zu verschieben und dabei gleichzeitig eine höhere zeitliche Auflösung zu erreichen. Dabei werden verschiedene Ansätze verfolgt, um sowohl durch Röntgendiffraktometrie (Röntgenbeugung) und Kristallografie im reziproken Raum (Impulsraum) als auch im Ortsraum Abbildung zu betreiben. Eine weitere Herausforderung ist die Bereitstellung der Proben und ihre Vorbereitung. Speziell für Proben in Lösung ist dafür erheblicher Aufwand nötig; der potenzielle Nutzen ist jedoch enorm.
Femtosekunden-Elektronenbeugung
Der Traum, der die Entwicklung der Femtosekunden-Elektronenbeugung (femtosecond electron diffraction, FED) befeuert, ist unter anderem, atomare Bewegungen während einer chemischen Reaktion zu beobachten. Die erste erfolgreiche Demonstration der Machbarkeit von atomarer Auflösung mit sub-Pikosekunden-Auflösung (weniger als ein Millionstel einer Millionstelsekunde) gelang 2003 mit der Beobachtung des ultraschnellen homogenen Schmelzens von Aluminium [1]. Dabei wurde die Veränderung von einem geordneten kristallinen Zustand hin zu einer Schmelze mit äußerst geringer Ordnung beobachtet. In diesem Fall handelte es sich um eine massive strukturelle Veränderung; es war jedoch nicht klar, ob auch dynamische Prozesse abgebildet werden könnten, die nur kleinere Bewegungen der Atome beinhalten. In den folgenden Jahren wurden weitere Schritte unternommen, um diese Fragen zu beantworten. Dazu wurde die Technologie der Elektronenquellen verbessert und die Expertise im Umgang mit Proben erweitert, was letztendlich im Jahr 2014 zum ersten molecular movie führte [2].
In Hamburg entwickelte die Gruppe eine neue Generation kompakter Elektronenkanonen, deren Design auf diesen früheren Arbeiten aufbaut. In Zusammenarbeit mit Wissenschaftlern aus Tokio wurde ein System untersucht, welches einen Phasenübergang von einem nichtleitenden Zustand mit geordneter Ladungskonfiguration zu einem metallischen Zustand aufweist. Das Material gehört zu einer Familie von aus Molekülen aufgebauten kristallinen Salzen, welche lichtinduzierte Phasenübergänge aufweisen. Dieser Übergang wurde genauer untersucht. Dabei wurde nicht nur die übergeordnete strukturelle Veränderung gefunden, sondern überraschenderweise auch weniger ausgeprägte kohärente Oszillationen, die den Prozess begleiten. Im Gegensatz zur klassischen Mikroskopie im Ortsraum muss bei Abbildung durch Beugung die gemessene Intensität invertiert werden. Ursprünglich war nicht klar, auf welchem Weg der Informationsgehalt der Daten am besten extrahiert werden kann. Das Problem dabei ist, dass für jeden Zeitpunkt die Zahl der Freiheitsgrade die Menge an Datensätzen um das Zehnfache übersteigt. Durch Kombination der Daten mit präzisem Wissen über den Anfangszustand des Systems kann jedoch die wahrscheinlichste Lösung für das Problem gefunden werden. So war es uns möglich, einen molecular movie mit beispiellosem Detailreichtum zu rekonstruieren, wie in Abbildung 1 gezeigt ist. Diese Studie zeigt auch, dass die Obergrenze dieser Technik, was die Komplexität der abgebildeten Struktur betrifft, noch nicht erreicht wurde. Trotzdem gibt es immer noch bedeutende Herausforderungen im Bereich von irreversiblen chemischen Reaktionen, die Kompromisse zwischen räumlicher, zeitlicher und struktureller Auflösung fordern werden.

Entwicklung gepulster Elektronenstrahlquellen und Nanokristallografie
Ein weiterer Schwerpunkt unserer Arbeit der letzten Jahre ist die Entwicklung von Experimentaufbauten und Techniken, die der Beobachtung biologischer und biochemischer Systeme auf deren inhärenten Längen- und Zeitskalen dienen. Dies gelingt uns mittels Einzelschuss-Proteinbeugung sowie kohärenter Beugungsabbildung mit Elektronen. Während diese Ansätze in großen Röntgenanlagen wie PETRA III bei DESY oder LCLS am SLAC bereits etabliert sind, könnten Elektronenstrahlen ähnliche Möglichkeiten in weitaus kleineren und günstigeren Laboraufbauten bieten. Aufgrund der Limitationen von Elektronenstrahlen hinsichtlich Helligkeit der Quelle und Raumladungseffekten entlang des Strahls stellt sich hierbei eine Zeitauflösung im Bereich von Nanosekunden bis Millisekunden als realistisch machbar heraus. Abgesehen von zeitaufgelöster Strukturauflösung erlauben es gepulste Elektronenstrahlen, die Strahlungsdosis an der Probe präzise zu kontrollieren, was Strahlungsschäden minimiert. Außerdem verhindern sie eine Verschmierung aufgrund von Probenbewegung. Zur Umsetzung dieses Ansatzes wurde eine technologische Plattform für die Erzeugung von gepulsten, feldemittierten Elektronenstrahlen entwickelt, die in drei unterschiedlichen Aufbauten für niedrige (ca. 100 eV), mittlere (10 keV) und hohe (300 keV) Energien realisiert wird. Die Kombination dieser Aufbauten wird Anwendungen in Protein-Nanokristallografie, Holografie und kohärenter Beugungsabbildung von komplexen Molekülen und organischen wie anorganischen inhomogenen Strukturen umfassen.
Derzeit arbeitet die Gruppe an einem Protokoll zu chipbasierter serieller Elektronen-Nanokristallografie, analog zu in unserer Gruppe entwickelten röntgenbasierten Methoden. Hier wurden bereits Fortschritte beim Laden der Chips mit Modellsystemen wie Lysozym und Katalase gemacht; Verfahren zur automatisierten Datenaufnahme und -analyse befinden sich in Entwicklung. Es wird erwartet, dass diese Entwicklungen völlig neue Möglichkeiten eröffnen werden, um routinemäßig statische und zeitaufgelöste Proteinstrukturen darzustellen. Auf Seiten der kohärenten Beugungsabbildung wurden, insbesondere zum Verfahren der Ptychografie, numerische und experimentelle Studien durchgeführt, um diese Technik im benötigen Regime von niedriger Dosis und relativ dicken Proben bei möglichst geringen Anforderungen an die Kohärenz des Elektronenstrahls zu etablieren. Erste Ergebnisse sind vielversprechend, sowohl im Hinblick auf atomare Auflösung ohne Einsatz von komplexer Elektronenoptik als auch auf die optimale Ausnutzung des detektierten Signals bezüglich der strukturellen Information.
Nanofluide Zelle für Bereitstellung flüssiger Proben
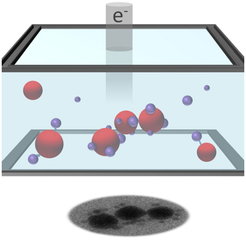
Die natürliche Umgebung für organische Proben und Zellen ist Wasser oder eine wässrige Nährlösung. Die mechanischen und chemischen Eigenschaften, Reaktionen und ihre Dynamik können ohne aufwändige Präparation nur im flüssigen Medium abgebildet werden. Daher unternimmt unsere Arbeitsgruppe einen erheblichen Aufwand, um flüssige Proben in für Elektronenuntersuchungen geeigneter Schichtdicke herzustellen. Idealerweise liegt die Dicke der Probe etwa in der gleichen Größenordnung wie die freie Weglänge der Elektronen im Material, da Vielfachstreuung die Auflösung verringert und die Interpretation der Ergebnisse erschwert. Innerhalb des letzten Jahres wurden dabei zwei Konzepte weiterentwickelt: statische und nanofluide Flüssigzellen. In diesen Zellen wird die flüssige Probe durch 50 Nanometer dünne Fenster vom Vakuum der Experimentierkammer getrennt und so vor dem Austrocknen geschützt. Bei den nanofluiden Zellen besteht die Schwierigkeit darin, einen schnellen Durchfluss der Probe sowie eine stabile Schichtdicke zu erreichen. Statische Zellen eignen sich für kleine Probenvolumina mit hoher Konzentration. Sie wurden beispielsweise eingesetzt, um die Multimerisierung von hybridisierten DNA-Basenpaaren zu untersuchen [4]. Die Studie folgte der Notwendigkeit, an Nanopartikel gebundene DNA-Stränge im flüssigen Medium zu beobachten (Abbildung 2).
Auch wenn die DNA nicht direkt beobachtet werden konnte, ließ die relative Bewegung der Nanopartikel Rückschlüsse über die Bindung der DNA-Stränge an ihrer Oberfläche zu. Die spezifische Bindung der hybridisierten Basenpaare konnte durch statistische Auswertung der beobachteten Nanopartikelmultimere nachgewiesen werden. Im Zuge dieses Experiments wurde eine weitere wichtige Beobachtung gemacht: Mitunter ließen sich kleinere Nanopartikel (20 nm) beobachten, wie sie sich an der „Leine“ der DNA frei bewegten; dabei wurden sie durch den Elektronenstrahl oft minutenlang belichtet. Aus dieser Bewegung lässt sich schließen, dass die DNA über die Beobachtungszeit intakt geblieben sein muss, obwohl bei Elektronenstrahlen mit einer Energie von 200 keV durchaus erhebliche Strahlenschäden zu erwarten sind. Diese ersten Ergebnisse geben einen vielversprechenden Ausblick auf unsere zukünftigen Experimente mit organischen Proben in flüssiger Umgebung bis hin zu lebendigem Zellmaterial.
![Abb.1: Ein molekularer Movie aus einzelnen Bildern, aufgenommen mithilfe der Femtosekunden-Elektronenbeugung. Erkennbar ist die Ausdehnung und Verdrehung der Dimere in Me4P[Pt(dmit)2]2 nach Anregung durch einen Laserpuls. Die Helligkeit der Punkte ist proportional zur Ordnungszahl der Atome, wobei schwerere Atome auch mehr zur Streuintensität beitragen. Gut zu erkennen sind die schweren Platinatome [3]. Abb.1: Ein molekularer Movie aus einzelnen Bildern, aufgenommen mithilfe der Femtosekunden-Elektronenbeugung. Erkennbar ist die Ausdehnung und Verdreh](https://www.mpg.de/11631419/original-1508158324.jpg?t=eyJ3aWR0aCI6ODQ4LCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MzE0MTl9--9129170dc18726fd28e4dbd7e9acf8cd1f2f83a5)
![Abb. 2: Illustration der Goldnanopartikel in einer Flüssigzelle während der Abbildung in einem Transmissionselektronenmikroskop (TEM) [4]. Abb. 2: Illustration der Goldnanopartikel in einer Flüssigzelle während der Abbildung in einem Transmissionselektronenmikroskop (TEM) [4].](https://www.mpg.de/11631427/original-1508158325.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MzE0Mjd9--4ee22e317a3536c5dcfebedc647720b6b1ab4785)